地址:苏州工业园区新平街388号A2-1003室
电话:0512-6558 5482 (苏州)
电话:025-5223 0375 (南京)
电话:182 6177 2925(济南)
邮编:215000
邮箱: sales@realgen-bio.com

明星产品
时间:2019-11-07 浏览次数:8900次
·产品描述
本试剂盒可以从少量的生物样品中快速提取高质量的总RNA,不使用酚和氯仿等有毒物质。具有操作简单快速、稳定性高、无毒的优势。适用于细胞和组织的RNA提取,提取得到的总RNA可用于RT-PCR、qPCR、Northern blotting、cDNA文库构建等多种实验。本试剂盒由裂解液、清洗液、洗脱液组成,其中裂解液(Lysis Buffer)中含有强变性剂和RNA酶抑制剂,能够迅速裂解样品并失活RNA酶,确保操作过程中RNA的完整性。本试剂盒大致的操作过程如下:首先用裂解液裂解样品;裂解好的样品加入乙醇混匀即可上柱,离心去掉液体将RNA结合在柱子上;杂质在清洗过程中被有效去除;洗脱RNA并用于下游实验。整个提取过程仅需10分钟。
·产品组成

* 第一次使用前,须向Wash Buffer加48ml 无水乙醇
·保存方法
Elution Buffer需要分装成小份室温保存,其余试剂和RNA柱室温保存(使用中谨防试剂被污染)。附赠的DNA酶收到后需置于-20 °C保存。
·使用建议
1.用于细胞样品时建议用6孔板或35mm培养皿培养细胞,培养至合适的密度进行 RNA提取(24孔板培养的细胞培养至90%以上的细胞密度也可使用)。不建议100mm培养皿培养的细胞直接进行RNA提取,否则可能导致细胞裂解不充分或因核酸过量导致离心柱堵塞或导致基因组残留。
2.用于组织样品时建议用于内脏组织、肿瘤组织等,不适用于皮肤等坚韧的组织。该试剂盒可提取5x104~3x106个细胞或10~100mg组织的RNA,对于T细胞/B细胞等体积很小、RNA含量很低的细胞,建议增加细胞数到至少1x106以上。
·操作步骤
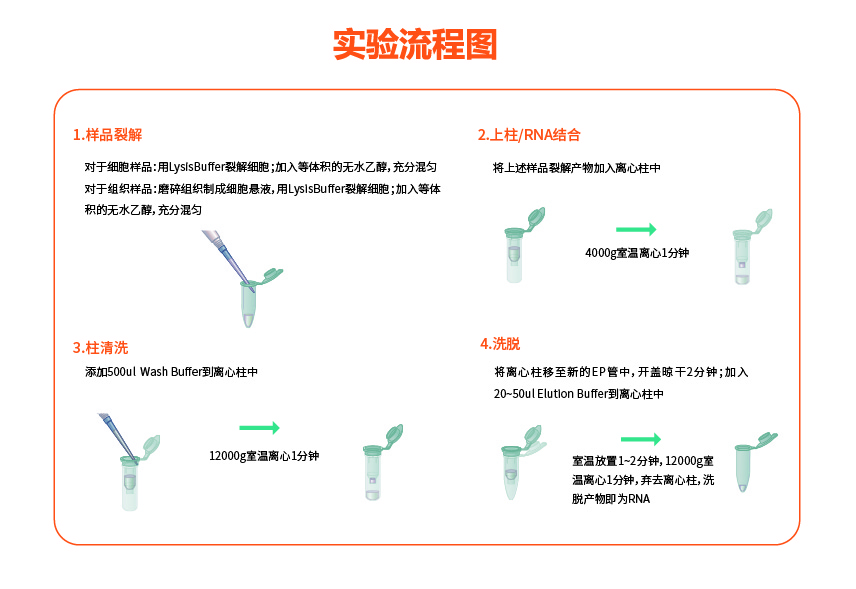
1. 样品裂解
1.1 对≤3x106/孔的贴壁细胞:
1)吸干培养基,用适量的PBS洗1次;
2)加入500μl的Lysis Buffer,枪头吹吸或搅拌数次,直至细胞完全裂解。转移至EP管中,vortex 10秒钟以充分裂解细胞;
1.2. 对>3 x 106/孔的贴壁细胞或悬浮细胞:
1)(本步适用于贴壁细胞。对于悬浮细胞,从步骤2开始操作)用胰酶消化将贴壁细胞悬浮起来;
2)取1~3x106个细胞的悬液至1.5 ml离心管,500 g离心3分钟收集细胞;
3)去上清,离心管中留约10~20 μl PBS,轻弹离心管重悬细胞沉淀;
4)加入500 μl的Lysis Buffer,用力吹吸10次,vortex 10秒钟,保证细胞完全裂解;
1.3 对动物组织(适用于内脏、肿瘤组织等,不适用于皮肤等坚韧的组织):
1)【重要】切取10~100mg的组织小块至1.5ml离心管,加入500ul PBS, 用组织匀浆机、手持匀浆仪或研磨棒磨碎组织,制成细胞悬液。组织必须充分匀浆,直至无肉眼可见的组织块。
2)12000 rmp离心1分钟,去除上清。离心管中留约30 μl PBS,轻弹离心管重悬细胞沉淀。
3) 吸取10~20 ul细胞悬液至1.5 ml离心管,加入500 μl的Lysis Buffer; 用力吹吸10次,vortex 10秒钟,保证细胞完全裂解;
4) 12,000 rmp离心1分钟,将上清转移到新的1.5ml离心管中;此步为了去除未被裂解的组织小块,以免后续操作堵塞离心柱。
2. 上柱/RNA提取
1)向裂解的细胞或组织中加入等体积的无水乙醇充分混匀(可能会产生沉淀,这是正常现象,继续进行操作即可)。可将离心管颠倒几次,或用移液器用力吹 吸10次使可能产生的沉淀分散开,然后将液体转移至离心住上。
2)4,000 g离心1分钟(相当于7000 rmp左右,如离心柱上仍有液体残留可增加转速至12,000 g离心)。
3. 柱清洗
1)向RNA柱中加入500μl的Wash Buffer,12,000 g离心1.5分钟(离心结束后取出柱子时注意不要让收集管内的废液接触到RNA柱,以免污染。可以倒掉废液,将RNA柱装回收集管,空管离心一次,能完全去除可能残留的Wash Buffer)。
3)将柱子放到干净的无RNA酶的1.5 ml离心管上,开盖晾干2分钟。此步骤为了彻底去除残余的乙醇。
2)可选操作:若实验对基因组的少量残留极其敏感,可用试剂盒附赠的DNA酶处理,具体处理方法详见最后一页:[常见问题及解决方案] 第4条。如果使用的逆转录试剂盒含DNA酶,则可省略本试剂盒的DNA酶处理。
3)将柱子放到干净的无RNA酶的1.5 ml离心管上,开盖晾干2分钟。此步骤为了彻底去除残余的乙醇。
4. RNA洗脱
1)在RNA柱的膜中心部位加入20~50 μl的Elution Buffer,室温静置2分钟。
2)12,000g离心1分钟(洗脱下来的RNA溶液重新加入柱中,静置5分钟,再次离心可提高洗脱效率,得到更多RNA)。(RNA洗脱下来后,建议置于冰上。)
3)测定洗脱的RNA浓度,以便于后续实验使用。提取出来的RNA可立即用于后续实验,也可保存在-80°C备用。
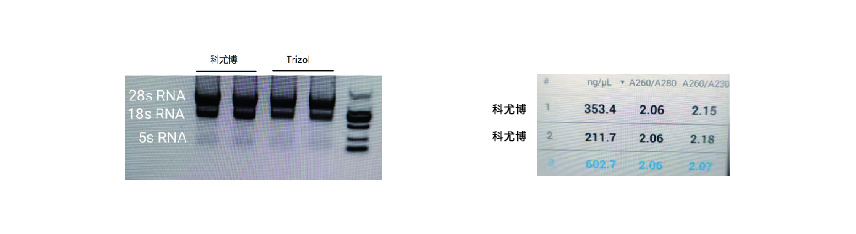
关于RNA浓度与纯度:本试剂盒提取RNA,使用Nanodrop等微量分光光度计测定0D 260/280在1.90~2.2之间均属正常(因不同仪器之间存在误差,若OD比值略有超出,但上下不超过0.1,且吸光度曲线正常,则亦可接受)。经检测,对于少量细胞样品,使用本试剂盒提取的RNA浓度最低不低于30ng/ul即可使用。
·实验结果
·常见问题解决方案
RNA产量过低,或用已经验证过的引物检测基因表达,检测到的内参基因Ct值偏大,或无法做出正常的扩增结果。
解决办法:
a. 检查所使用的试剂是否受到污染:建议试剂盒开封后, 每种buffer分装为2份每次使用时应严格按照规溯作,防止交叉污染。
b. 溶解好的引物应该分装为小份冻存,以减少引物降解及降低污染的可能性。
c. 检查操作流程是否正确,例如:
1. 除DNA酶以外的所有试剂均须室温保存。若冷藏保存,应提前取出,温度恢复至室温之后方可使用。整个RNA提取的操作过程必须在室温进行,不可置于冰上(直至洗脱离心后得到 RNA方可置于冰上),以避免其间产生不溶物堵塞离心柱;
2. Wash Buffer使用前需加入48毫升无水乙醇混匀才可使用;
3. 细胞或组织裂解产物,上柱前需要加入等体积的无水乙醇,充分混匀后加入离心柱中离心;
4. 可选步骤:若实验对基因组的少量残留极其敏感,可用试剂盒附赠DNA酶处理:RNA经wash buffer清洗一次后,按照每个样品2 μl DNase + 2 μl 10x Reaction buffer加16 μl DEPC水(或Elution Buffer),混匀后加入离心柱中央,室温放置5分钟,然后加入 Wash Buffer清洗一次去除DNA酶,进行后续操作;
5. 洗涤时需用12,000 g高速离心充分去除Wash Buffer,然后开盖晾干2分钟;
6. 洗脱液的体积可以根据需要在一定范围内调整(一般20-50μl,最少不可少于10 μl ,否则无法充分溶解RNA),以浓度满足后续实验需求为宜。重复洗脱一次及延长放置时间至5分钟均可提高RNA产量。
7. 若细胞体积较大以往采用TRIzol试剂提取RNA时需用100 mm培养皿培养细胞, 建议使用本试剂盒时仍然使用35mm培养皿培养细胞,本试剂盒最低可提取5万个左右常规细胞的RNA(T、B细胞等体积极小的细胞除外),能满足绝大多数逆转录和qPCR的实验需要。经测试,本试剂盒最多大约可提取30μg左右的总RNA。
8. 组织匀浆应在PBS中充分研磨成细胞悬液,切勿在lysis buffer中匀浆。